
المادة في الفيزياء هي أي شيء له كتلة وحجم وكثافة يشكل ما يُعرف بالكون الملموس. والمادة جزء من هذا الكون فكل شيء في الكون يتكون من مادة، كالأجسام والأشياء المحيطة بنا.
ما هي أنواع الطاقة؟ وكيف يحدث التحول بين أشكال الطاقة؟
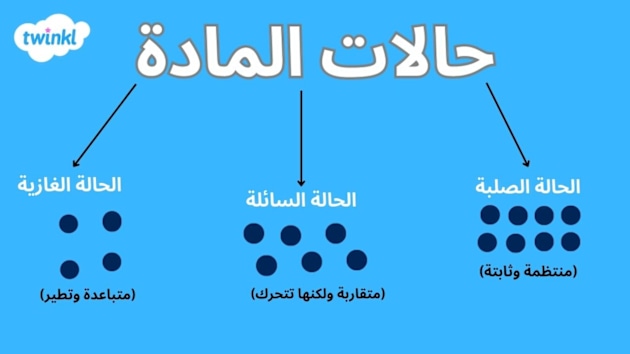
تتواجد المادة في الكون في ثلاث حالات: صلبة أو سائلة أو غازية، تمتلك المادة الصلبة بشكل عام حجمًا وشكلًا محددًا يمكنها الاحتفاظ به بغض النظر عن مكان وجودها. على سبيل المثال القلم رَصاص لا يتغير حجمه أو شكله إذا تم نقله من سطح المكتب ووُضِعَ بشكل عمودي في كوب. والمادة السائلة مثل المادة الصلبة لها حجم محدد لكن ليس لها شكل ثابت محدد فهي تأخذ شكل المكان الذي تتواجد به فمثلًا يتغير شكل الماء الموجود في كوب إذا سُكب في وعاء له شكل آخر لكن حجمه يظل كما هو. والمادة الغازية تتمدد لملء الحجم الكامل لحاويتها.
عندما تتغير درجة الحرارة والضغط للمادة الصلبة أو السائلة أو الغازية فسوف تتغير حالتها أيضًا، على سبيل المثال يتغير الجليد من الحالة الصلبة إلى السائلة إذ تعرض لدرجات حرارة عالية، وعند ارتفاع درجة الحرارة بشكل كبير سيغلي هذا السائل ويتحول إلى بخار وهو الحالة الغازية.
تتكون جميع المواد من وحدات صغيرة تسمى الذرات وتتكون كل ذرة من مركز ضخم موجب الشحنة يسمى النواة والذي يطير حوله واحد أو أكثر من الإلكترونات سالبة الشحنة.وتحتوي النواة نفسها على بروتون واحد على الأقل وهو جسيم موجب الشحنة وفي جميع الذرات، باستثناء ذرات الهيدروجين العادي، تحتوي النواة أيضًا على نيوترون واحد على الأقل وهو جسيم ليس له شحنة كهربائية، وتحتوي الذرة المحايدة على نفس عدد الإلكترونات مثل البروتونات لذلك تُلغى الشحنات الكهربائية.
ويتم تحديد هُوِيَّة الذرة وعددها الذري من خلال عدد البروتونات في نواتها، على سبيل المثال يوجد بروتون واحد في نواة ذرة الهيدروجين لذلك يحتوي الهيدروجين على الرقم الذري 1، والأكسجين له ثمانية بروتونات فيكون رقمه الذري 8 ويحتوي الزئبق على80 بروتون ورقمه الذري 80 ورقم اليورانيوم الذري 92.
تُسمى المواد التي تتكون من نوع واحد فقط من الذرات بالعناصر حيث يوجد 92 عنصرًا فقط بشكل طبيعي على الأرض بكميات كبيرة أخفها الهيدروجين وأثقلها هو اليورانيوم.
في درجات الحرارة العالية للغاية تكون ذرات الإلكترونات متحررة من نواها والخليط الناتج من الجسيمات السالبة والموجبة الحرة يسمى البلازما، يعتبر العلماء أن حالة البلازما هي الحالة الرابعة للمادة، على سبيل المثال في الفضاء تكون المادة في النجوم ساخنة للغاية بحيث تنفصل الإلكترونات تمامًا عن النوى فينتج خليط البلازما.
يمكن أيضًا دراسة حالات المادة على أساس القصور الذاتي (أو الخُمول) والجاذبية، حيث يمكن تعريف المادة على أنها أي شيء يعاني من القصور الذاتي ويتعرض لقوة جذابة عندما يكون في مجال الجاذبية.
تصنف خصائص المادة في فئتين رئيستين: الفيزيائية والكيميائية.
----------------
اقرأ أيضًا:
المعادن
لمّ لا تطّلع على بعض مواردنا الرائعة لتدريس العلوم من هنا؟
مورد علوم رائع يحتوي على مفردات ورسوم ملونة حول تحولات المادة.
تحتوي الشرائح على الحقائق الأساسية حول المادة الموضحة بإيجاز والتي يسهل قراءتها وتحتوي كل شريحة إعلامية أيضًا على رسوم توضيحية للمادة التي تتم مناقشها، بالإضافة إلى أمثلة عن كيفية استخدامها في صنع الأشياء اليومية.
مجموعة من البطاقات تحتوي على مفردات وصور متعلقة بتحولات المواد. المورد مفيد للمساعدة في تدريس موضوع المادة وتحولاتها في العلوم.
بوربوينت: صُلْب أم سائل أم بخار؟
هذه الوسيلة التعليمية هي مِلَفّ بوربوينت متميز يتناول درس من دروس مادة العلوم للصف الأول الابتدائي وهو درس حالات المادة، يمكنك الاعتماد على هذه الوسيلة في شرح كل شيء عن درس حالات المادة، وأنواعها، وتقسيمها إلى الحالة الصلبة، والسائلة، والغازية، وذلك بمساعدة أمثلة من الأشياء التي توجد حوله لتقريب الفكرة الأساسية للدرس وتبسيطه قدر المستطاع.
ورقة عمل تغيير حالة المواد: الثلج والماء والبخار
استخدم ورقة العمل العملية هذه في صف العلوم لتلاميذ المرحلة الثانية لتعليمهم حول تغيير حالات المادة، وذلك باستخدام مثال الماء. يمكن أن يتخذ الماء أشكال متعددة مثل الماء الذي نشربه والثلج والبخار دون أن يتعرض لتفاعل كيميائي، نتيجة للحرارة الشديدة أو البرودة.
صور مواد مصهورة لدرس تحولات المادة
ويتضمن هذا المورد ١٤ صورة مختلفة لمواد يمكن انصهارها وتحولها من الشكل الصُّلْب إلى السائل مثل الزبدة والشوكولا والشمع والمعادن والبلاستيك والمثلجات وأقلام الشمع والجليد والجبن والزجاج.