في هذا الشارح، سوف نتعلَّم كيف نكتب ونفسِّر الرموز المُستخدَمة في الصِّيَغ الكيميائية.
تتكوَّن الجزيئات والمُركَّبات من ذرات وأيونات متنوِّعة. وقد طوَّر الكيميائيون طُرقًا للحديث عن هذه الجزيئات والمركَّبات للتمييز بينها، وللإشارة إلى تركيبها. لنتناول جزيء الماء.

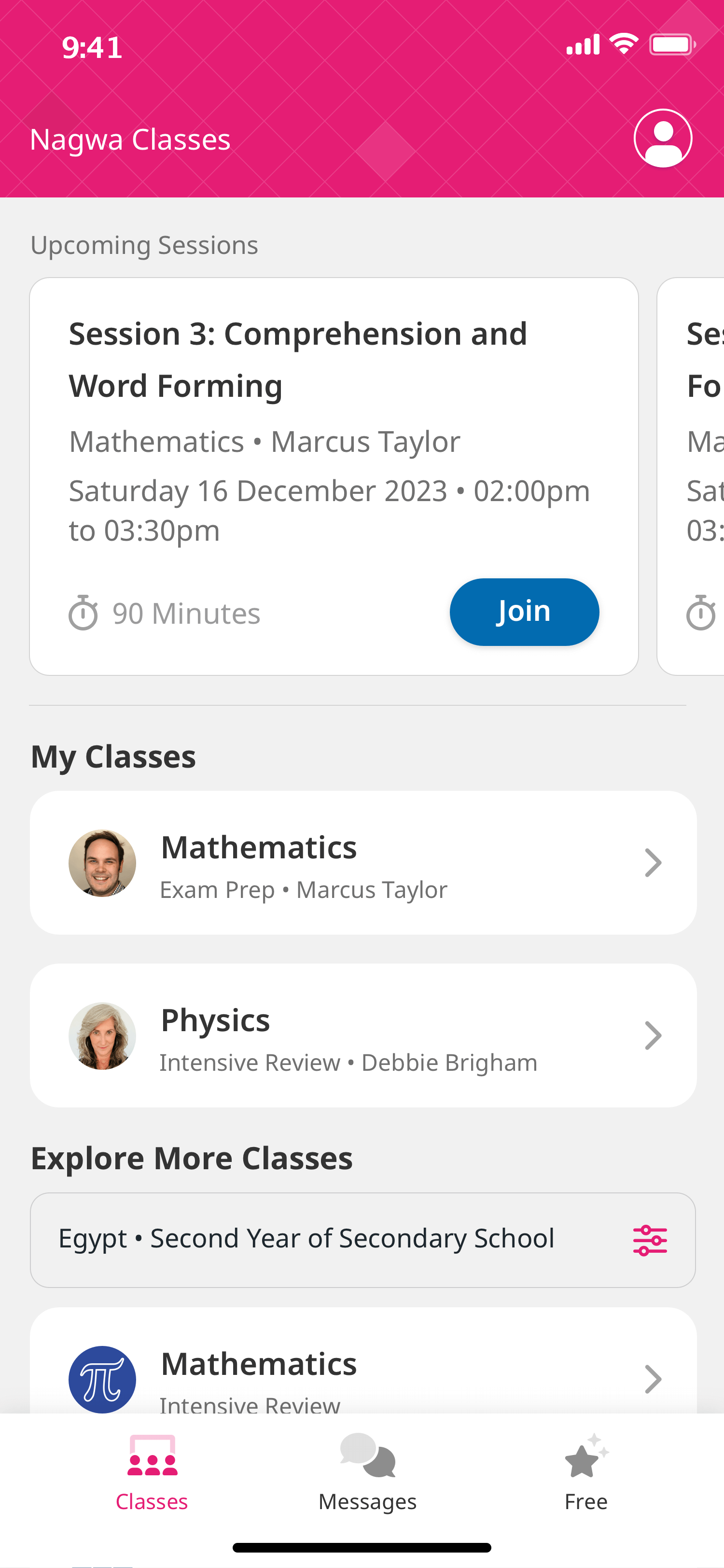
تتكوَّن جزيئات الماء من ذرتَيْ هيدروجين وذرة أكسجين. يُمكننا تمثيل تركيب جزيء الماء بكتابة الرمزين الكيميائيين لذرات الهيدروجين والأكسجين، واستخدام أرقام سُفلية للإشارة إلى عدد كلِّ نوع من الذرات:
هذه هي الصيغة الكيميائية للماء. حيث تُمثَّل ذرات الهيدروجين والأكسجين بالرمزين الكيميائيين ، ، ويُمثَّل عدد كلِّ نوع من الذرات برقم سُفلي. تُكتَب القِيَم السُّفلية الأكبر من الواحد، لكن قيمة الواحد السُّفلية تُفهَم ضمنيًّا فقط ولا تُكتَب. ولهذا السبب تُكتَب الصيغة الكيميائية للماء على الصورة ، وليس .
تعريف: الصيغة الكيميائية
تعبير بالرموز الكيميائية والأرقام السُّفلية التي تمثِّل تركيب وحدة واحدة من مركَّب.
لنتناول عيِّنة تحتوي على ثلاثة جزيئات ماء.

نحن نعلم أن كلَّ جزيء ماء له الصيغة الكيميائية . يُمكننا وضْع العدد ثلاثة قبل هذه الصيغة الكيميائية للإشارة إلى وجود ثلاثة جزيئات ماء: . العدد ثلاثة معامل. تُشير المعاملات إلى عدد الوحدات المستقلَّة (الجزيئات أو وحدات الصيغة). من المُهِمِّ أن نميِّز بين القِيَم السُّفلية والمعاملات. القِيَم السُّفلية تُشير دائمًا إلى عدد الذرات أو الأيونات في وحدة واحدة من المركَّب، بينما تُشير المعاملات إلى عدد الوحدات المستقلَّة.
مثال ١: حساب إجمالي عدد ذرات عنصر في صيغة مُركَّب
ما عدد ذرات الأكسجين الموجودة بالصيغة ؟
الحل
بالنظر إلى الصيغة، يُمكننا أن نلاحِظ أن لدينا نوعين مختلفين من الأرقام: المعاملات والأرقام السُّفلية. المعاملات أرقام تَظهَر أمام الصيغة الكيميائية. وتُشير حدود المعامل إلى عدد الوحدات المستقلَّة. ومن ثَمَّ، فالقيمة 10 في الصيغة الكيميائية تُشير إلى وجود 10 جزيئات مستقلَّة.
الأرقام السُّفلية أرقام تَظهَر بعد الرمز الكيميائي في الصيغة الكيميائية. تُشير الأرقام السُّفلية إلى عدد الذرات أو الأيونات في وحدة واحدة. ويُفترَض أن تُوجَد القِيَم السُّفلية على الجانب الأيمن للرمز الكيميائي، إذا لم يكن هناك عددٌ آخَر مكتوبٌ في هذه المساحة. ومن ثَمَّ، جزيء واحد من يحتوي على ذرة كبريت واحدة وذرتَيْ أكسجين.
بالانتباه لهذه المعلومات، يُمكننا الإجابة عن هذا السؤال بطريقتين. إذا عرفنا أن الجزيء الواحد من يحتوي على ذرتَيْ أكسجين، إذن يجب أن تحتوي 10 جزيئات على 10 أمثال هذا العدد من ذرات الأكسجين، كما هو موضَّح في المعادلة الآتية:
علاوة على ذلك، يُمكن حساب إجمالي عدد الذرات الموجودة في الصيغة بتوزيع المعامِل على الأرقام السُّفلية.

ومن ثَمَّ، ستحتوي الصيغة على 10 في ذرة كبريت واحدة، و10 في ذرتي أكسجين. إذن يُوجَد 20 ذرة أكسجين في الصيغة .
بالإضافة إلى الصِّيَغ الكيميائية، يُمكن أن يُشير الكيميائيون إلى الجزيئات والمركَّبات بأسمائها. ويجب اتِّباع قواعد واصطلاحات متنوِّعة للتسمية حتى يُشير الاسم الكيميائي إلى مركَّب واحد فقط. سنركِّز على تسمية المركَّبات الجزيئية الثنائية والمركَّبات الأيونية البسيطة.
يتكوَّن المركَّب الجزيئي الثنائي من ذرات عنصرين مختلفين مرتبطين تساهُميًّا معًا. عادة ما تكون العناصر المعنية لا فلزية، لكنْ يُمكن أن تكون أشباه فلزات أيضًا.

بشكلٍ عامٍّ، ستُكتَب الصيغة الكيميائية للمركَّب الجزيئي الثنائي بالرمز الكيميائي للعنصر ذي السالبية الكهربية الأصغر أولًا، متبوعًا بالرمز الكيميائي للعنصر ذي السالبية الكهربية الأكبر.

تُوجَد استثناءات لهذه القاعدة العامة. وفيما يأتي ترتيب للعديد من اللافلزات الشائعة عند كتابتها جزءًا من الصيغة الكيميائية الجزيئية الثنائية:
من السهل تسمية المركَّبات الجزيئية الثنائية التي لا تتكوَّن من الكربون والهيدروجين فقط، وذلك باتِّباع بعض القواعد البسيطة.
كيفية تسمية مركَّب جزيئي ثنائي غير هيدروكربوني
- اكتب اسم العنصر الذي يَظهَر أولًا في الصيغة الكيميائية.
- اكتب جذر اسم العنصر الذي يَظهَر ثانيًا في الصيغة الكيميائية.
- أضِف لاحقة «ـيد» إلى الجذر.
- أضِف بادئةً قبل اسم كلِّ نوع للإشارة إلى عدد ذرات هذا العنصر في الصيغة الكيميائية. إذا كان هناك ذرة واحدة فقط من العنصر الأول، فلا تكتب بادئةً قبل اسمه.
البوادئ اليونانية المُستخدَمة عند تسمية المركَّبات الجزيئية الثنائية عدد الذرات البادئة 1 أحادي- (لا تُستخدَم قطُّ قبل اسم العنصر الأول) 2 ثنائي- 3 ثلاثي- 4 رباعي- 5 خماسي- 6 سداسي- 7 سباعي- 8 ثماني- 9 تساعي- 10 عشاري- - في حالة كتابة اسم المركَّب باللغة الإنجليزية: إذا كانت البادئة الموجودة قبل الأكسجين أو الأكسيد تنتهي بالحرف a أو o، يُمكن حذف الحرف الأخير من البادئة.
باتِّباع قواعد تسمية المركَّبات الجزيئية الثنائية، يُمكننا تسمية برباعي أكسيد ثنائي النيتروجين.

هناك العديد من المركَّبات الجزيئية الثنائية التي لا تُسمَّى عادة باتِّباع الاصطلاحات، وإنما يُشار إليها عادة بأسمائها الشائعة. ويوضِّح الجدول الآتي أمثلة على ذلك.
| بعض أمثلة المركَّبات الجزيئية الثنائية وأسماؤها الشائعة | |
|---|---|
| الصيغة الكيميائية | الاسم الشائع |
| الماء | |
| الأمونيا | |
| غاز الضحك | |
| الميثان | |
| كبريتيد الهيدروجين | |
| الفوسفين | |
مثال ٢: تسمية مركَّب جزيئي ثنائي
ما اسم المركَّب الذي يحتوي على ذرة كلور وذرتَيْ أكسجين؟
الحل
باستخدام الجدول الدوري، يُمكننا تحديد أن الكلور ( ) والأكسجين ( ) من اللافلزات. المركَّبات التي تحتوي على عنصرين لا فلزيَّيْن مركَّبات جزيئية ثنائية. وعادةً ما تُكتَب صيغة المركَّب الجزيئي الثنائي واسمه بالعنصر ذي السالبية الكهربية الأصغر أولًا، متبوعًا بالعنصر ذي السالبية الكهربية الأكبر بعد ذلك. ولكنْ عند اتِّحاد الكلور أو البروم أو اليود مع الأكسجين، يُكتَب الهالوجين دائمًا أولًا. ومن ثَمَّ، سيَظهَر الكلور قبل الأكسجين في كلٍّ من الصيغة والاسم.
لتسمية مركَّب جزيئي ثنائي، نبدأ بكتابة اسم العنصر الأول، وهو الكلور في هذه الحالة:
بعد ذلك، نكتب جذر اسم العنصر الثاني متبوعًا باللاحقة «ـيد»:
بعد ذلك، علينا الإشارة إلى عدد ذرات كلِّ عنصر في المركَّب بإضافة بادئة يونانية قبل اسم العنصر المناظِر. تُوجَد ذرة كلور وذرتا أكسجين في المركَّب. البادئة اليونانية للواحد هي «أحادي-»، والبادئة اليونانية لاثنين هي «ثنائي-». لا تُوضَع البادئة «أحادي-» قبل العنصر الأول قط. ومن ثَمَّ، سنُضِيف البادئة «ثنائي-» قبل الأكسيد فقط:
إذن اسم المركَّب الذي يحتوي على ذرة كلور وذرتَيْ أكسجين سيكون ثنائي أكسيد الكلور.
مثال ٣: تحويل اسم مركَّب كيميائي معقَّد به بادئات إلى صيغة كيميائية
ما الصيغة الكيميائية لسباعي أكسيد ثنائي الكلور؟
الحل
الصيغة الكيميائية تعبيرٌ بالرموز الكيميائية والأرقام السُّفلية التي تمثِّل تركيب وحدة واحدة من مركَّب. قبل أن نتمكَّن من كتابة الصيغة الكيميائية، يجب أن نحدِّد نوع المركَّب أولًا؛ لأن الأنواع المختلفة من المركَّبات لها قواعد مختلفة للتسمية وكتابة الصيغة.
تُشير البادئتان «ثنائي» و«سباعي» إلى أن هذا اسم مركَّب جزيئي. لكتابة الصيغة الكيميائية لمركَّب جزيئي، يُمكننا أن نبدأ بفصْل الاسم إلى بادئات وكلمات جذرية ولواحِق.

يُمكن استخدام الكلمات الجذرية لتحديد العناصر الموجودة في المركَّب. العنصر الأول هو الكلور، الذي رمزه الكيميائي . والعنصر الثاني جذره «أكس». باستخدام الجدول الدوري، يُمكننا تحديد العنصر الذي له هذا الجذر بأنه الأكسجين، الذي رمزه الكيميائي . يُمكننا كتابة هذين الرمزين الكيميائيين بالترتيب نفسه الذي يَظهَر به العنصران في الاسم:
تُشير البادئات إلى عدد ذرات كلِّ عنصر. البادئة «ثنائي» تعني اثنين، والبادئة «سباعي» تعني سبعة. وحيث إننا نمثِّل عدد ذرات كلِّ عنصر في الصيغة الكيميائية برقم سُفلي يَظهَر بعد العنصر مباشرة. ومن ثَمَّ، يُمكننا وضْع الرقم اثنين بشكلٍ سُفلي بعد ، والرقم سبعة بشكلٍ سُفلي بعد :
الصيغة الكيميائية لسباعي أكسيد ثنائي الكلور هي .
تتكوَّن المركَّبات الأيونية من كاتيونات موجبة الشحنة وأنيونات سالبة الشحنة مرتبطة ببعضها من خلال التداخلات الكهروستاتيكية. وتكون الكاتيونات بوجهٍ عامٍّ أيونات فلزية، والأنيونات بوجهٍ عامٍّ أيونات لا فلزية. يوضِّح الشكل الآتي شحنات العديد من الأيونات الشائعة.

عادةً ما تكون عناصر الفئة d في الجدول الدوري قادرةً على تكوين أيونات ذات شحنات متعدِّدة. على سبيل المثال، يُمكن أن تُكوِّن ذرة الحديد أيون أو أيون .
تُوجَد المركَّبات الأيونية في صورة شبكة ثلاثية الأبعاد مكوَّنة من العديد من الكاتيونات والأنيونات، بدلًا من وجودها في صورة وحدات جزيئية مستقلَّة. من المستحيل تحديد إجمالي عدد الكاتيونات والأنيونات في مركَّب أيوني له صيغة كيميائية. وبدلًا من ذلك، تمثِّل الصيغة الكيميائية أبسط نسبة من الكاتيونات والأنيونات، مع كتابة اسم الكاتيون أولًا. على سبيل المثال، يتكوَّن ملح الطعام من العديد من أيونات الصوديوم ( ) وأيونات الكلوريد ( )، لكن نسبة أيونات الصوديوم إلى أيونات الكلوريد في المركَّب هي . ومن ثَمَّ، فالصيغة الكيميائية لملح الطعام هي .
وبالمثل ستكون الصيغة الكيميائية لمركَّب أيوني يتكوَّن من أيونات المغنيسيوم ، وأيونات البروميد هي .

يُمكن أن تحتوي المركَّبات الأيونية على أيونات متعدِّدة الذرات. الأيونات المتعدِّدة الذرات هي الكاتيونات أو الأنيونات المكوَّنة من نوعين مختلفين على الأقلِّ من الذرات. على سبيل المثال، الفوسفات أيون متعدِّد الذرات شحنته ، ويتكوَّن من ذرة فوسفور وأربع ذرات أكسجين.

بالمثل تُكتَب الصِّيَغ الكيميائية للمركَّبات الأيونية التي تحتوي على أيونات بسيطة أحادية الذرة أو أيونات أكثر تعقيدًا متعدِّدة الذرات. لنتناول مركَّبًا يتكوَّن من أيونات الفوسفات وأيونات الزنك، .

هناك حاجة إلى ثلاثة أيونات زنك وأيونَيْ فوسفات لكي يكون المركَّب متعادلًا كهربيًّا. ومن ثَمَّ، تكون الصيغة الكيميائية لهذا المركَّب هي:
لاحِظ أن الأيون المتعدِّد الذرات يُوضَع داخل قوسين مع كتابة الرقم اثنين بشكلٍ سُفلي خارج القوسين. يُشير هذا الرقم السُّفلي إلى وجود أيونَيْ فوسفات.
يوضِّح الجدول الآتي العديد من الأيونات الشائعة المتعدِّدة الذرات.
| أيونات متعدِّدة الذرات | ||
|---|---|---|
| الشحنة | اسم الأيون | صيغة الأيون |
| الأمونيوم | ||
| البيكربونات | ||
| الهيدروكسيد | ||
| النيترات | ||
| النيتريت | ||
| الكربونات | ||
| الكبريتات | ||
| الكبريتيت | ||
| الفوسفات | ||
من الأسهل تحديد الصيغة الكيميائية للمركَّبات الأيونية باستخدام مجموعة من الخطوات البسيطة بدلًا من الرسوم المعقَّدة.
كيفية كتابة الصيغة الكيميائية لمركَّب أيوني
- اكتب الرمز الكيميائي وشحنة الكاتيون متبوعَيْن بالرمز الكيميائي وشحنة الأنيون.
- احذف علامتَيْ .
- أعِدْ كتابة القِيَم العُلوية في صورة قِيَم سُفلية بعد الرمز الكيميائي المقابل. وإذا وُضِع رقم سُفلي بعد أيون متعدِّد الذرات، ضع الأيون المتعدِّد الذرات داخل قوسين متبوعًا بالرقم السُّفلي.
- إذا كان الرقمان السُّفليان الجديدان المكتوبان يَشترِكان في عامل مُشترَك، يُبَسَّطان.
لنتناول مركَّبًا يتكوَّن من أيون وأيون . نبدأ بكتابة الكاتيون متبوعًا بالأنيون:
بعد ذلك، نحذف علامتَيْ ، ، ونُعيد كتابة الرقمين في صورة رقمين سُفليين على النوعين بالعكس:

لاحِظ أن الأيون المتعدِّد الذرات وُضِع داخل قوسين وكُتِب الرقم أربعة بشكلٍ سُفلي خارج القوسين.
يُمكن تبسيط الصيغة الكيميائية بقسمة الرقمين السُّفليين اثنين وأربعة على عاملهما المُشترَك الأكبر:
مثال ٤: استنتاج الصيغة الأيونية لمركَّب أيوني تكون فيه شحنتا الأيونين أكبر من الواحد
شحنة أيونات الحديد الثلاثي ، وشحنة أيونات الأكسيد . ما صيغة أكسيد الحديد الثلاثي؟
الحل
لتحديد الصيغة الكيميائية لمركَّب أيوني، يُمكننا البدء بكتابة الرمز الكيميائي وشحنة الكاتيون الموجب الشحنة، متبوعَيْن بالرمز الكيميائي وشحنة الأنيون السالب الشحنة. الرمز الكيميائي للحديد هو . والأكسيد اسم أنيون الأكسجين، ورمزه الكيميائي . ومن ثَمَّ، نكتب:
بعد ذلك نحذف علامتَيْ ، ، ونُعيد كتابة الرقمين في صورة رقمين سُفليين بعد النوع المعاكس:

نتحقَّق من أن الرقمين السُّفليين لا يَشترِكان في عامل مُشترَك، ولا يُمكن تبسيطهما. إذن صيغة أكسيد الحديد الثلاثي هي .
بالإضافة إلى الصيغة الكيميائية، يُمكن أيضًا تحديد المركَّبات الأيونية باستخدام أسمائها الكيميائية.
كيفية تسمية المركَّب الأيوني
- اكتب اسم الكاتيون، وهو النوع الذي يَظهَر أولًا في الصيغة الكيميائية؛ ويكون للكاتيونات الأحادية الذرة اسم العنصر نفسه.
- اكتب اسم الأنيون، وهو النوع الذي يَظهَر ثانيًا في الصيغة الكيميائية. تُسمَّى الأنيونات الأحادية الذرة بكتابة جذر اسم العنصر متبوعًا باللاحقة «ـيد».
- إذا كان الكاتيون عنصرًا يُمكن أن يُكوِّن أيونات متعدِّدة الشحنات (على سبيل المثال ، )، يجب كتابة مقدار شحنة الكاتيون في صورة رقم روماني داخل قوسين بعد اسم الكاتيون. وإذا كانت شحنة الكاتيون مجهولة، يُمكن تحديد مقدار الشحنة باستخدام المعادلة الآتية:
لنتناول مركَّب . نبدأ بتسمية الكاتيون. الكاتيون هو النوع الذي يَظهَر أولًا في الصيغة الكيميائية. يَظهَر أولًا وهو أحادي الذرة؛ أيْ يحتوي على ذرة واحدة فقط. ومن ثَمَّ يُسمَّى النحاس:
الأنيون هو ، وهو أيون متعدِّد الذرات يُسمَّى الكبريتات:
النحاس عنصر يُمكن أن يُكوِّن أيونات متعدِّدة الشحنات. سنحتاج إلى تحديد أيون النحاس الموجود في المركَّب بكتابة مقدار شحنة الأيون في صورة رقم روماني داخل قوسين بعد كلمة النحاس. يُمكننا تحديد مقدار شحنة أيون النحاس باستخدام المعادلة الآتية:
يجب أن ننتبه عند حساب الأيونات المتعدِّدة الذرات؛ لأن الصيغة الكيميائية للأيون المتعدِّد الذرات عادةً ما تحتوي على أرقام سُفلية. إذا كانت الصيغة الكيميائية تحتوي على أكثر من وحدة لنوعٍ واحدٍ من أيون متعدِّد الذرات، يُكتَب الأيون داخل قوسين، ويُكتَب الرقم السُّفلي خارج القوسين.
في الصيغة الكيميائية ، يُوجَد كاتيون نحاس واحد وأيون كبريتات واحد شحنته . بالتعويض بالقِيَم في المعادلة:
مقدار شحنة الكاتيون لأيون النحاس هذا يساوي اثنين، وهو ما يعني أن شحنة كلِّ كاتيون نحاس هي . نكتب مقدار شحنة الكاتيون في صورة رقم روماني داخل قوسين بعد اسم الكاتيون:
مثال ٥: تسمية مركَّب أيوني ثنائي
ما اسم المركَّب المكوَّن من الكالسيوم والفلور؟
الحل
الكالسيوم فلز، والفلور لا فلز. والفلزات واللافلزات تُكوِّن عادةً مركَّبات أيونية عند اتِّحادها معًا. يُوجَد عنصر الكالسيوم في المجموعة الثانية من الجدول الدوري. يُمكن أن تُكوِّن ذرات عناصر هذه المجموعة كاتيونات شحنتها . ويُوجَد عنصر الفلور في المجموعة 17. ويُمكن أن تُكوِّن ذرات عناصر هذه المجموعة أنيونات شحنتها .
عند كتابة الصِّيَغ الكيميائية الأيونية والأسماء، سيكون الكاتيون هو النوع الأول، ثم يَلِيه الأنيون. ويكون اسم الكاتيون هو اسم العنصر نفسه:
الأنيون أحادي الذرة؛ أيْ يتكوَّن من ذرة واحدة. تُسمَّى الأنيونات الأحادية الذرة بأخْذ جذر اسم العنصر وإضافة اللاحقة «ـيد»:
الكالسيوم يُكوِّن أيونات شحنتها فقط. ومن ثَمَّ لا يتعيَّن علينا تحديد شحنة الكاتيون بالأرقام الرومانية. ومن ثَمَّ يكون اسم المركَّب المكوَّن من الكالسيوم والفلور هو فلوريد الكالسيوم.
يُمكن استخدام مخطط التتابع الآتي لمُساعَدتنا في تسمية وكتابة الصِّيَغ الكيميائية للمركَّبات الأيونية والتساهُمية البسيطة. لا يُمكن استخدام مخطَّطات التتابع هذه مع المركَّبات الأيونية والتساهُمية الأكثر تعقيدًا، ولا يُمكن استخدامها لتسمية الهيدرات أو الأحماض أو المركَّبات العضوية.


النقاط الرئيسية
- تُشير الصيغة الكيميائية إلى نوع وعدد الذرات في الجزيء أو وحدة الصيغة.
- تُشير الأرقام السُّفلية في الصيغة الكيميائية إلى عدد الذرات أو الأيونات، بينما تُشير المعاملات التي تُوجَد قبل الصيغة الكيميائية إلى عدد جزيئات وحدات الصيغة.
- عادة ما تُكتب أسماء المركَّبات الجزيئية وصِيَغها الكيميائية بدءًا بالعنصر ذي السالبية الكهربية الأصغر أولًا.
- تُدرَج البادئات في أسماء المركَّبات الجزيئية الثنائية للإشارة إلى عدد ذرات كلِّ عنصر في المركَّب.
- تُكتَب أسماء المركَّبات الأيونية وصِيَغها الكيميائية بدءًا بالكاتيون أولًا.
- تُدرَج الأرقام الرومانية في اسم المركَّب الأيوني عندما يكون عنصر الكاتيون قادرًا على تكوين أيونات متعدِّدة الشحنات.